Đề thi Học kì 2 Hóa 10 cực hay có đáp án !!
Câu 1 : Trong số các nguyên tố halogen sau đây, nguyên tố nào có hàm lượng lớn nhất trong vỏ trái đất?
A. Flo.
B. Clo.
C. Brom.
D. Iot.
Câu 2 : Chất rắn X màu vàng, được dùng để sản xuất H2SO4. Chất X là
A. KClO3.
B. KMnO4.
C. FeS2.
D. S.
Câu 3 : Kim loại nào sau đây không tác dụng với H2SO4loãng?
A. Mg.
B. Fe.
C. Cu.
D. Na.
Câu 4 : Cho phương trình hóa học: N2(k) + 3H2(k) 2NH3(k) ΔH < 0
A. Nồng độ.
B. Áp suất.
C. Nhiệt độ.
D. Chất xúc tác.
Câu 5 : Tốc độ phản ứng hóa học được xác định bằng độ biến thiên trong một đơn vị thời gian của đại lượng nào sau đây?
A. Nồng độ.
B. Thể tích.
C. Áp suất.
D. Nhiệt độ.
Câu 6 : Sục khí SO2từ từ đến dư vào nước brom (màu vàng), thấy
A. nước brom mất màu và có kết tủa trắng.
B. nước brom mất màu và có kết tủa vàng.
C. nước brom bị mất màu.
D. dung dịch vẩn đục màu vàng.
Câu 7 : Thí nghiệm điều chế khí Z được mô tả ở hình bên.
A. CaCO3CaO + CO2.
B. 2KClO3 2KCl + 3O2.
C. Na2SO3+ H2SO4Na2SO4+ SO2+ H2O.
D. Zn + H2SO4ZnSO4+ H2.
Câu 8 : Hòa tan hoàn toàn 11,2 gam bột Fe vào dung dịch HCl dư, thấy thoát ra V lít khí H2(đktc). Giá trị của V là
A. 2,24.
B. 4,48.
C. 8,96.
D. 6,72.
Câu 9 : Axit clohiđric thể hiện tính khử trong phản ứng nào sau đây?
A. 4HCl + MnO2 MnCl2+ Cl2+ 2H2O.
B. 2HCl + CuOCuCl2+ H2O.
C. 2HCl + Mg(OH)2 MgCl2+ 2H2O.
D. 2HCl + Na2CO32NaCl + CO2+ H2O.
Câu 10 : Ở điều kiện thường, brom tồn tại ở trạng thái
A. khí.
B. lỏng.
C. rắn.
D. plasma.
Câu 11 : Cho sơ đồ chuyển hóa sau:
A. 3.
B. 2.
C. 1.
D. 0.
Câu 12 : Cho các cặp chất sau tác dụng với nhau:
A. 4.
B. 3.
C. 1.
D. 2.
Câu 13 : Cho các phát biểu sau:
A. 0.
B. 2.
C. 3.
D. 1.
Câu 14 : Hiện nay, axit sunfuric được tổng hợp từ lưu huỳnh theo phương pháp tiếp xúc kép qua ba giai đoạn với hiệu suất của toàn bộ quá trình đạt 88%. Theo quá trình trên, từ 1,00 tấn lưu huỳnh có thể sản xuất được bao nhiêu tấn dung dịch H2SO498%?
A. 2,75.
B. 2,70.
C. 3,13.
D. 3,56.
Câu 15 : Cho 2,06 gam muối NaX tác dụng với dung dịch AgNO3dư. Toàn bộ kết tủa sinh ra được phân hủy hoàn toàn, thu được 2,16 gam bạc. Muối NaX là
A. NaF.
B. NaCl.
C. NaI.
D. NaBr.
Câu 20 : Axit nào sau đây có trong dịch vị dạ dày, giúp tiêu hóa thức ăn?
A. H2SO4.
B. HCl.
C. HClO.
D. H2S.
Câu 21 : Lưu huỳnh đioxit là một trong những tác nhân chính gây ra hiện tượng mưa axit. Công thức hóa học của lưu huỳnh đioxit là
A. SO2.
B. H2SO3.
C. SO3.
D. H2S.
Câu 22 : Kim loại nào sau đây không tác dụng với dung dịch H2SO4 đặc, nguội?
A. Mg.
B. Fe.
C. Cu.
D. Na.
Câu 23 : Cho phương trình hóa học: 2SO2(k) + O2(k) 2SO3(k) ΔH < 0
A. Nồng độ.
B. Áp suất.
C. Nhiệt độ.
D. Chất xúc tác.
Câu 24 : Yếu tố nào dưới đây không ảnh hưởng đến tốc độ phản ứng?
A. Chất xúc tác.
B. Thể tích của hệ.
C. Diện tích bề mặt tiếp xúc.
D. Nồng độ.
Câu 25 : Sục khí SO2từ từ đến dư vào dung dịch axit H2S, thấy
A. có kết tủa vàng.
B. có kết tủa đen.
C. có kết tủa trắng.
D. có kết tủa nâu đỏ.
Câu 26 : Thí nghiệm điều chế khí Z được mô tả ở hình bên.
A. CaCO3CaO + CO2.
B. 2KClO3 2KCl + 3O2.
C. Na2SO3+ H2SO4Na2SO4+ SO2+ H2O.
D. Zn + H2SO4ZnSO4+ H2.
Câu 27 : Hòa tan hoàn toàn 7,2 gam bột Mg vào dung dịch HCl dư, thấy thoát ra V lít khí H2(đktc). Giá trị của V là
A. 13,44.
B. 3,36.
C. 4,48.
D. 6,72.
Câu 28 : Dãy nào sau đây gồm các chất đều tác dụng được với dung dịch HCl?
A. NaHCO3, KOH, NaCl.
B. BaSO4, CuS, Cu.
C. CaCO3, AgNO3, CuO.
D. NaOH, KNO3, HF.
Câu 29 : Ở điều kiện thường, iot tồn tại ở trạng thái
A. khí.
B. lỏng.
C. rắn.
D. plasma.
Câu 30 : Cho sơ đồ chuyển hóa sau:
A. 3.
B. 2.
C. 1.
D. 0.
Câu 31 : Cho cặp chất sau tác dụng với nhau:
A. 4.
B. 3.
C. 2.
D. 1.
Câu 32 : Cho các phát biểu sau:
A. 2.
B. 0.
C. 3.
D. 1.
Câu 33 : Hiện nay, axit sunfuric được tổng hợp từ lưu huỳnh theo phương pháp tiếp xúc kép qua ba giai đoạn với hiệu suất của toàn bộ quá trình đạt 88%. Theo quá trình trên, từ 2,00 tấn lưu huỳnh có thể sản xuất được bao nhiêu tấn dung dịch H2SO498%?
A. 6,25.
B. 5,39.
C. 5,50.
D. 7,10.
Câu 34 : Cho 2,34 gam muối NaX tác dụng với dung dịch AgNO3dư. Toàn bộ kết tủa sinh ra được phân hủy hoàn toàn, thu được 4,32 gam bạc. Muối NaX là
A. NaF.
B. NaCl.
C. NaBr.
D. NaI.
Câu 39 : Cho các cặp chất sau:
A. 5.
B. 7.
C. 4.
D. 6.
Câu 40 : Để nhận ra sự có mặt của ion sunfat trong dung dịch, người ta thường dùng
A. quỳ tím.
B. dd muối Mg2+
C. thuốc thử duy nhất là Ba(OH)2
D. dd chứa ion Ba2+.
Câu 41 : Hấp thụ hoàn toàn 5,6 lít khí SO2(đktc) vào 400 ml dung dịch NaOH 1M. Khối lượng muối thu được sau phản ứng là: (Cho Na = 23; S = 32; O = 16; H = 1)
A. 24,5 gam.
B. 18,9 gam.
C. 10,4 gam.
D. 29,3 gam.
Câu 42 : Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. PbS.
B. H2S.
C. SO2.
D. K2SO4.
Câu 43 : Các nguyên tố thuộc nhóm oxi - lưu huỳnh có bao nhiêu electron ở phân lớp ngoài cùng?
A. 1
B. 3
C. 4
D. 2
Câu 44 : Anion X2-có cấu hình electron lớp ngoài cùng là 2s22p6. Nguyên tố X là
A. S.
B. O.
C. Cl.
D. F.
Câu 45 : Cho FeS tác dụng với dung dịch HCl, khí bay ra là
A. Cl2.
B. H2S.
C. H2.
D. SO2.
Câu 46 : Khi sục SO2vào dung dịch NaOH theo tỉ lệ \(\frac{{{n_{NaOH}}}}{{{n_{S{O_2}}}}} = 2\) thu được dung dịch
A. NaHSO3, Na2SO3.\(\)
B. NaHSO3
C. Na2SO3.
D. Na2SO4.
Câu 47 : Trong các nguyên tử nguyên tố nhóm halogen, chất ở trạng thái khí màu lục nhạt là
A. Iot.
B. Brom.
C. Clo.
D. Flo.
Câu 48 : Phần trăm khối lượng của S có trong phân tử Fe2(SO4)3
A. 8%.
B. 24%.
C. 16%.
D. 28%.
Câu 49 : Cho 11,2 gam bột Fe tác dụng với dung dịch HCl dư thu được V lít khí H2bay ra (đktc). Thể tích V lít khí thoát ra là?
A. 2,24.
B. 3,36.
C. 4,48.
D. 44,8.
Câu 50 : Khí oxi không phản ứng được với
A. Cu.
B. S.
C. Fe.
D. Cl2.
Câu 51 : Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2và NaCl (có tỉ lệ số mol tương ứng là 1 : 2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3(dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
A. 28,7.
B. 68,2.
C. 57,4.
D. 10,8.
Câu 52 : Kim loại không phản ứng với axit H2SO4đặc, nguội là
A. Ag.
B. Fe.
C. Cu.
D. Zn.
Câu 53 : Cho 15,8 gam KMnO4tác dụng hoàn toàn với dung dịch HCl đặc, dư. Thể tích khí thu được (đktc) là:
A. 5,6 lít.
B. 4,48 lít.
C. 8,96 lít.
D. 0,6 lít.
Câu 54 : Các số oxi hoá có thể có của S trong hợp chất là
A. –2; +4; +6.
B. –2; +4; +6; 0.
C. +4; +6; 0.
D. -2; 0; +4.
Câu 55 : Oxi có thể thu được từ phản ứng nhiệt phân chất nào sau đây?
A. NaHCO3.
B. (NH4)2SO4.
C. KMnO4.
D. CaCO3.
Câu 56 : Hoà tan 8,8 gam hỗn hợp X gồm Mg và Cu trong axit H2SO4loãng dư, sau khi phản ứng xảy ra thì thu được 4,48 lít khí H2(đktc). Số gam của Mg và Cu trong hỗn hợp X lần lượt là
A. 4,8 và 4.
B. 6,4 và 2,4.
C. 2,4 và 6,4.
D. 4 và 4,8.
Câu 57 : Hợp chất của lưu huỳnh có tính tẩy màu là
A. H2SO4 loãng.
B. H2S.
Câu 58 : Để điều chế SO2trong công nghiệp người ta tiến hành như sau:
A. Đốt cháy S hoặc quặng pirit sắt (FeS2).
B. Cho kim loại phản ứng với H2SO4 đặc.
C. Cho dd Na2SO3+ ddH2SO4.
D. Cho Na2SO3tinh thể + ddH2SO4, đun nóng.
Câu 59 : Nhiệt phân hoàn toàn 4,385 gam hỗn hợp X gồm KClO3và KMnO4 thu được O2và m gam hỗn hợp chất rắn. Toàn bộ lượng O2sinh ra tác dụng hết với cacbon nóng đỏ, thu được 0,896 lít hỗn hợp khí có tỉ khối so với hidro là 16. Phần trăm về khối lượng của KMnO4trong hỗn hợp đầu là
A. 73,85.
B. 75,76.
C. 79,18.
D. 72,06.
Câu 60 : Để pha loãng dd H2SO4đậm đặc, trong phòng thí nghiệm, người ta tiến hành theo cách nào trong các cách sau đây:
A. Cho nhanh nước vào axit và khuấy đều.
B. Cho nhanh axit vào nước và khuấy đều.
C. Cho từ từ axit vào nước và khuấy đều.
D. Cho từ từ nước vào axit và khuấy đều.
Câu 61 : Phản ứng mà SO2thể hiện tính khử là?
A. SO2+ 2H2S → 3S + 2H2O.
B. SO2+ 2NaOH → Na2SO3+ H2O.
C. SO2+ H2O ⇄ H2SO3.
D. 2SO2+ O2⇄ 2SO3.
Câu 62 : Cấu hình e lớp ngoài cùng của nguyên tử các nguyên tố halogen là
A. ns2 np5.
B. ns2np3.
C. ns2np4.
D. ns2np6.
Câu 63 : Phương pháp điều chế khí hidroclorua trong phòng thí nghiệm là
A. NaCl tinh thể và H2SO4 đặc.
B. Thủy phân AlCl3.
C. Clo tác dụng với H2O.
D. Tổng hợp từ H2và Cl2.
Câu 64 : Trong các phản ứng sau, phản ứng nào thể hiện tính oxi hóa của lưu huỳnh đơn chất?
A. S + HNO3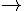 SO2+ NO2+ H2O.
SO2+ NO2+ H2O.
B. S + Hg 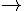 HgS.
HgS.
C. S + Na2SO3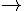 Na2S2O3.
Na2S2O3.
D. S + O2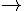 SO2.
SO2.
Câu 65 : Oxi tác dụng với tất cả các chất trong nhóm nào dưới đây?
A. K, Mg, Cl2.
B. Na, I2, N2.
C. Mg, Al, N2.
D. Ca, Au, S.
Câu 66 : Cho phương trình phản ứng Cu + H2SO4đ→ CuSO4+ SO2+ H2O.
A. 2.
B. 1.
C. 4.
D. 3.
Câu 67 : Dãy nào sau đây được sắp xếp theo chiều tăng dần của tính phi kim?
A. F, Cl, Br, I.
B. Cl, Br, F, I.
C. Br, Cl, F, I.
D. I, Br, Cl, F.
Câu 68 : Cho phản ứng: SO2 + Cl2 + 2H2O \( \to \) 2HCl + H2SO4. Clo là chất đóng vai trò chất
A. oxi hóa.
B. khử.
C. vừa oxi hóa, vừa khử.
D. không oxi hóa khử.
Câu 69 : Nhóm kim loại nào sau đây không có phản ứng với H2SO4 loãng?
A. Zn, Al.
B. Mg, Cu.
C. Cu, Ag.
D. Ag, Fe.
Câu 70 : Kim loại nào sau đây khi tác dụng với dung dịch HCl và khí clo đều cho cùng một loại muối
A. Hg.
B. Cu.
C. Mg.
D. Fe.
Câu 71 : Trong phân tử H2S nguyên tử S có
A. số oxi hoá +6.
B. số oxi hoá +4.
C. số oxi hoá -2.
D. số oxi hoá +2.
Câu 72 : Phản ứng chứng tỏ ozon có tính oxi hoá mạnh hơn oxi là
A. C2H5OH + 3O2→ 2CO2+ 3H2O.
B. 3C + 2O3→ 3CO2.
C. 2Ca + O2→ 2CaO.
D. 2Ag + O3→ Ag2O + O2.
Câu 73 : Công thức của clorua vôi là
A. CaO2Cl.
B. CaOCl2.
C. CaOCl.
D. Ca2OCl.
Câu 74 : Axit không thể đựng trong bình thủy tinh là
A. HNO3.
B. H2SO4.
C. HCl.
D. HF.
Câu 75 : Cho phản ứng 2Fe(OH)3+ 3H2SO4→ X + 6H2O. Tên X là?
A. Sắt (III) sunfit.
B. Sắt (III) sunfat.
C. Sắt (III) sunfua.
D. Sắt (III) sunfurơ.
Câu 76 : Liên kết trong các phân tử đơn chất halogen là gì?
C. liên kết ion.
Câu 77 : A. Clo.
C. Flo.
Câu 78 : Cho các chất: C, Cu, FeS, FeO, Fe(OH)2, Fe2O3, Fe(OH)3, NaCl rắn. Số chất tác dụng với H2SO4 đ, nóng tạo chất khí là
C. 6.
Câu 80 : Tiến hành thí nghiệm như hình vẽ:
Câu 87 : 1.Bằng phương pháp hóa học (không dùng chất chỉ thị màu), hãy phân biệt các dung dịch mất nhãn sau:
Câu 88 :
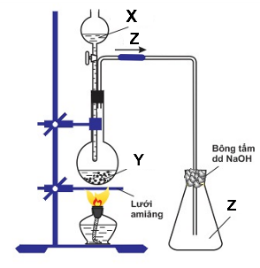 1.Cho sơ đồ thí nghiệm sau:
1.Cho sơ đồ thí nghiệm sau:
Câu 92 : 1.Bằng phương pháp hóa học (không dùng chất chỉ thị màu), hãy phân biệt các dung dịch mất nhãn sau:
Câu 94 : 1.Cho sơ đồ thí nghiệm sau:
Câu 96 : Cấu hình electron lớp ngoài cùng tổng quát của nguyên tử các nguyên tố nhóm VIA là
C. ns1np5.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. Ba(OH)2.
B. AgNO3.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
Câu 97 : Clorua vôi có ứng dụng nào sau đây?
B. Dùng trong tinh chế dầu mỏ.
C. Khử chua cho đất nhiễm phèn.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. HNO3.
B. HCl.
A. Ba(OH)2.
B. AgNO3.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
Câu 98 : Cấu hình electron nguyên tử của Cl (Z = 17) là
C. 1s22s22p63s23p5.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. Ba(OH)2.
B. AgNO3.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
Câu 99 : Khí SO2 đóng vai trò là chất oxi hóa trong phản ứng nào sau đây ?
C. 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. Ba(OH)2.
B. AgNO3.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
Câu 100 : Axit nào sau đây có khả năng ăn mòn thủy tinh ?
C. H2SO4.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. Ba(OH)2.
B. AgNO3.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
Câu 101 : A. 51,84 tấn.
C. 64,00 tấn.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. Ba(OH)2.
B. AgNO3.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
Câu 102 : Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25oC). Trường hợp nào sau đây tốc độ phản ứng không đổi?
B. Thực hiện phản ứng ở 500C.
C. Dùng dung dịch H2SO4 gấp đôi ban đầu.
A. 76,92%.
B. 61,54%.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. Ba(OH)2.
B. AgNO3.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
Câu 103 : Cho cân bằng hóa học: PCl5 (k) PCl3 (k) + Cl2 (k) ; ∆H > 0
C. tăng áp suất của hệ phản ứng.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. Ba(OH)2.
B. AgNO3.
Câu 104 : Cho cân bằng hóa học (trong bình kín):
C. (1), (2), (3).
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 105 : Số oxi hóa của Cl trong hợp chất HClO là
C. +5.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 106 : Dãy axit nào sau đây được sắp xếp đúng theo thứ tự lực axit tăng dần ?
C. HCl < HBr < HI < HF.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 107 : Phản ứng của cặp chất nào sau đây xảy ra ở điều kiện thường là phản ứng thuận nghịch ?
C. Fe và HCl.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 108 : Dùng không khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào ảnh hưởng đến tốc độ phản ứng ?
C. Diện tích tiếp xúc.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 109 : Dãy nào sau đây được sắp xếp đúng theo thứ tự giảm dần tính oxi hóa của các đơn chất halogen ?
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 110 : Cho cân bằng sau trong bình kín:
C. ∆H > 0, phản ứng thu nhiệt.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 111 : Hòa tan hoàn toàn 7,8 gam hỗn hợp Mg và Al bằng dung dịch HCl dư. Sau phản ứng thấy khối lượng dung dịch tăng thêm 7,0 gam so với ban đầu. Khối lượng Al và Mg trong hỗn hợp đầu lần lượt là
C. 1,2 gam và 6,6 gam.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 112 : Dãy chất gồm những chất vừa thể hiện tính oxi hóa, vừa thể hiện tính khử là
C. F2, SO2, H2S.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 113 : Cho 20,8 gam hỗn hợp gồm Cu và CuO tác dụng với dung dịch H2SO4 đặc nóng dư thì thu được 4,48 lít một khí không màu, mùi hắc (sản phẩm khử duy nhất, ở đktc). Thành phần phần trăm khối lượng CuO trong hỗn hợp ban đầu là
C. 38,46%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 114 : Nhiệt phân 3,634 gam KMnO4 thu được V ml khí O2 (ở đktc), biết phản ứng xảy ra hoàn toàn. Giá trị V là
C. 257,6 ml.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
A. Ba(OH)2.
B. AgNO3.
Câu 115 : Dung dịch thuốc thử nào sau đây có thể dùng để phân biệt dung dịch NaCl với dung dịch NaBr ?
C. BaCl2.
A. 76,92%.
B. 61,54%.
A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột.
A. Nhiệt độ, áp suất.
B. Nồng độ.
A. Tẩy trắng tinh bột, dầu ăn.
A. HNO3.
B. HCl.
A. thêm PCl3 vào hệ phản ứng.
B. tăng nhiệt độ của hệ phản ứng.
Câu 116 : Cho 7,84 lít khí SO2(đktc) hấp thụ hoàn toàn vào 150 ml dung dịch NaOH 1M thu được m muối. Giá trị của m là
A. 15,6 gam
B. 8,4 gam
C. 18,9 gam
D. 9,45 gam
Câu 117 : Cho m gam Mg tác dụng hoàn toàn với H2SO4loãng, dư. Sau phản ứng thu được 0,448 lit H2(đktc). Giá trị của m là
A. 0,96 gam
B. 0,56 gam
C. 0,48 gam
D. 0,36 gam
Câu 118 : Cho các phát biểu sau:
A. 2
B. 3
C. 5
D. 4
Câu 119 : Phản ứng được dùng điều chế oxi trong phòng thí nghiệm là:
A. 2Ag + O3Ag2O + O2.
B. 2H2O2H2+ O2.
C. 2KMnO4K2MnO4+ MnO2+ O2.
D. MnO2+ 4HCl MnCl2+ O2+ 2H2O.
Câu 120 : Khí sunfurơ là một chất khí không màu, mùi hắc, dễ tan trong nước và là một trong số chất chính gây ra mưa axit. Công thức hóa học của khí sunfurơ là
A. H2S
B. SO3
C. S
Câu 121 : Kim loại bị thụ động hóa với H2SO4đặc nguội là
A. Fe, Zn.
B. Al, Mg.
C. Al, Zn
D. Fe, Al.
Câu 122 : Dùng dung dịch nào sau đây để nhận biết ion clorua (Cl-)
A. phenolphtalein
B. quỳ tím
C. BaCl2
D. AgNO3
Câu 123 : Cho phương trình hóa học:
A. 9
B. 6
C. 18
D. 8
Câu 124 : Cho dung dịch AgNO3đến dư vào 200 ml dung dịch NaCl 1,5M. Khối lượng kết tủa thu được là
A. 71,75 gam
B. 28,7 gam
C. 32,4 gam
D. 43,05 gam
Câu 125 : Trong phòng thí nghiệm, khi tiến hành thí nghiệm cho mảnh đồng vào ống nghiệm chứa H2SO4đặc, đun nóng thấy sinh ra chất khí SO2có mùi hắc, độc. Biện pháp nào sau đây xử lý khí thoát ra chống ô nhiễm môi trường?
A. Dùng bông tẩm nước đặt lên miệng ống nghiệm
B. Dùng bông tẩm dung dịch H2SO4đặt lên miệng ống nghiệm
C. Dùng bông tẩm dung dịch NaOH đặt lên miệng ống nghiệm
D. Dùng bông tẩm cồn (ancol etylic) đặt lên miệng ống nghiệm.
Câu 126 : Phản ứng nào sau đây, H2S đóng vai trò là chất khử ?
A. 2H2S + 3O22SO2+ 2H2O
B. KOH + H2S KHS + H2O
C. 2NaOH + H2S Na2S + 2H2O
D. H2S+ Pb(NO3)2 PbS+ 2HNO3
Câu 127 : Một chất dùng để làm sạch nước, dùng để chữa sâu răng và có tác dụng bảo vệ các sinh vật trên trái đất không bị ảnh hưởng của bức xạ tia cực tím. Chất này là:
A. Oxi
B. Clo
C. Natri florua
D. Ozon
Câu 128 : Dung dịch nào sau đây làm quỳ tím hóa đỏ
A. Na2SO4.
B. HCl.
C. KCl.
D. NaOH.
Câu 129 : Cho phản ứng Br2+ HCOOH → 2HBr + CO2
A. 2,17.10-7mol/l.s
B. 3,8.10-7mol/l.s
C. 2,17.10-4mol/l.s
D. 3,8.10-8mol/l.s
Câu 130 : Hòa tan 74,7 gam một oleum vào nước thu được dung dịch A. Để trung hòa dung dịch A cần vừa đủ 300 ml dung dịch Ba(OH)23M. Công thức của oleum là
A. H2SO4.4SO3
B. H2SO4.3SO3
C. H2SO4.6SO3
D. H2SO4.5SO3
Câu 131 : Hiện tượng xảy ra khi dẫn khí SO2vào dung dịch brom là
A. dung dịch brom mất màu.
B. có khí mùi hắc thoát ra.
C. có kết tủa màu vàng.
D. có khói màu nâu đỏ.
Câu 132 : Trong các phản ứng sau, phản ứng nào sai?
C. 2Fe + 3H2SO4 (loãng)→ Fe2(SO4)3+3H2
Câu 133 : Cho cân bằng hóa học: N2(k) + 3H2 (k)2NH3(k) ; ∆H < 0.
A. Tăng nồng độ H2.
B. Thêm chất xúc tác.
C. Tăng nhiệt độ.
D. Giảm nồng độ NH3.
Câu 134 : Dẫn 5,6 lít khí H2S (đktc) qua dung dịch Pb(NO3)2dư thu được m gam kết tủa. Giá trị của m là
A. 59,75 gam
B. 23,90 gam
C. 47,80 gam
D. 27,25 gam
Câu 135 : Axit nào dưới đây có khả năng ăn mòn thủy tinh?
A. HF
B. HCl đặc
C. HNO3đặc
D. H2SO4đặc
Lời giải có ở chi tiết câu hỏi nhé! (click chuột vào câu hỏi).
Copyright © 2021 HOCTAP247
